Tofasitinibisitraatti on reseptilääke (kauppanimi Xeljanz), jonka Pfizer on alun perin kehittänyt oraalista Janus-kinaasin (JAK) estäjien luokkaa varten. Se voi selektiivisesti inhiboida JAK-kinaasia, estää JAK/STAT-reittejä ja siten estää solusignaalin transduktiota ja siihen liittyvien geenien ilmentymistä ja aktivaatiota, jota käytetään nivelreuman, psoriaattisen niveltulehduksen, haavaisen paksusuolitulehduksen ja muiden immuunisairauksien hoitoon.
Lääke sisältää kolme annosmuotoa: tabletit, depottabletit ja oraaliset liuokset. Sen tabletit hyväksyttiin ensimmäisen kerran FDA:ssa vuonna 2012, ja FDA hyväksyi pitkävaikutteisen annosmuodon helmikuussa 2016. Se on ensimmäinen, joka hoitaa niveliä. Yan on JAK-estäjä, joka otetaan suun kautta kerran päivässä. Joulukuussa 2019 uusi pitkävaikutteisten lääkkeiden käyttöaihe hyväksyttiin uudelleen keskivaikeaan tai vaikeaan aktiiviseen haavaiseen paksusuolitulehdukseen (UC). Lisäksi läiskäpsoriaasin nykyiset vaiheen 3 kliiniset tutkimukset on saatu päätökseen ja meneillään on vielä kuusi vaiheen 3 kliinistä tutkimusta, jotka koskevat aktiivista psoriaattista niveltulehdusta, juveniili idiopaattista niveltulehdusta jne. Käyttöaiheet. Pitkävaikutteisten ja vain kerran päivässä otettavien depottablettien edut edistävät potilaiden sairauksien hallintaa ja hallintaa.
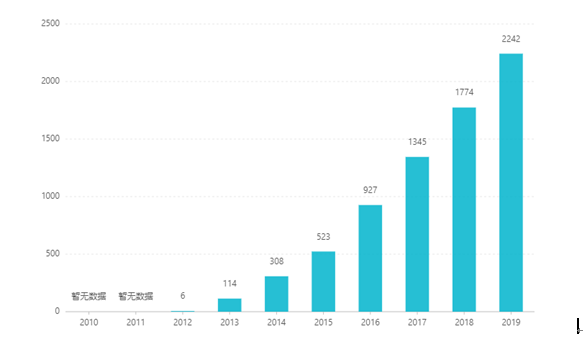
Listautumisen jälkeen sen myynti on kasvanut vuosi vuodelta ja noussut 2,242 miljardiin dollariin vuonna 2019. Kiinassa tabletin annosmuoto hyväksyttiin markkinointiin maaliskuussa 2017, ja se pääsi neuvottelujen kautta sairausvakuutuksen B-kategoriaan vuonna 2019. Viimeisin voitto tarjous on 26,79 RMB. Depotvalmisteiden korkeiden teknisten esteiden vuoksi tätä annosmuotoa ei kuitenkaan ole vielä markkinoitu Kiinassa.
JAK-kinaasilla on tärkeä rooli tulehduksissa, ja sen estäjien on osoitettu hoitavan tiettyjä tulehdus- ja autoimmuunisairauksia. Tähän mennessä 7 JAK-estäjää on hyväksytty maailmanlaajuisesti, mukaan lukien Leo Pharman delgocitinibi, Celgenen fedratinibi, AbbVien upatinibi, Astellasin pefitinibi, Eli Lillyn baritinibi ja Novartisin rokotinibi. Kuitenkin vain tofasitinibi, baritinibi ja rokotinibi on hyväksytty Kiinassa edellä mainituista lääkkeistä. Odotamme innolla, että Qilun "Tofatib Citrate Sustained Release Tablets" -tabletit hyväksytään mahdollisimman pian ja hyödyttävät useampia potilaita.
Kiinassa NMPA hyväksyi alkuperäisen tofasitibisitraattitutkimuksen maaliskuussa 2017 sellaisten aikuisten nivelreumapotilaiden hoitoon, joilla ei ole riittävää tehoa tai jotka eivät siedä metotreksaattia, kauppanimellä Shangjie. Meinenetin tietojen mukaan tofasitibisitraattitablettien myynti Kiinan julkisissa lääketieteellisissä laitoksissa vuonna 2018 oli 8,34 miljoonaa yuania, mikä oli paljon vähemmän kuin sen maailmanlaajuinen myynti. Suuri osa syynä on hinta. On raportoitu, että Shangjien alkuperäinen vähittäismyyntihinta oli 2085 yuania (5mg*28 tablettia) ja kuukausikustannukset 4170 yuania, mikä ei ole pieni taakka tavallisille perheille.
On kuitenkin syytä juhlia, että tofasitibi sisällytettiin Sairausvakuutuslaitoksen vuoden 2019 ”Valtakunnalliseen perussairausvakuutus-, työtapaturmavakuutus- ja äitiysvakuutuslääkeluetteloon” neuvottelujen jälkeen marraskuussa 2019. Kuukausimaksua kerrotaan laskevan. alle 2 000 juaniin hinnanalennuksesta neuvoteltuaan, mikä parantaa huomattavasti lääkkeen saatavuutta.
Elokuussa 2018 Valtion henkisen omaisuuden viraston patentin uudelleentarkastelulautakunta teki uudelleentarkastelupäätöksen nro 36902 mitätöintivaatimuksen ja julisti mitättömäksi Pfizertofatibin ydinpatentin, yhdistepatentin, koska eritelmä ei ole julkistettu riittävästi. Pfizertofatiibin kidemuodon patentti (ZL02823587.8, CN1325498C, hakemuspäivä 2002.11.25) päättyy kuitenkin vuonna 2022.
Insight-tietokanta osoittaa, että alkuperäisen tutkimuksen lisäksi viisi geneeristä lääkettä Chia Tai Tianqingista, Qilusta, Kelunista, Jangtsejoesta ja Nanjing Chia Tai Tianqingista on hyväksytty markkinointiin kotimaisissa tofasitinibitablettiformulaatioissa. Kuitenkin depottablettityypin osalta vain alkuperäinen tutkimus Pfizer jätti markkinointihakemuksen 26. toukokuuta. Qilu on ensimmäinen kotimainen yritys, joka on jättänyt markkinointihakemuksen tästä formulaatiosta. Lisäksi CSPC Ouyi on BE-kokeiluvaiheessa.
Changzhou Pharmaceutical Factory (CPF) on johtava API-valmistajien, valmiiden formulaatioiden lääkevalmistaja Kiinassa, joka sijaitsee Changzhoussa, Jiangsun maakunnassa. CPF on perustettu vuonna 1949. Olemme omistautuneet tofacitinib-sitraatille vuodesta 2013 ja toimittaneet jo DMF:n. Olemme rekisteröityneet moniin maihin ja voimme tukea sinua parhaiden asiakirjojen tuella Tofacitinib Citrate -tuotteelle.
Postitusaika: 23.7.2021